2023 年 10 月 23 日,北京朝阳医院陶勇、中国科学院过程工程研究所魏炜、马光辉院士等在 Nature 子刊 Nature Biomedical Engineering(IF=29.234)上发表了题为:Exosome-loaded degradable polymeric microcapsules for the treatment of vitreoretinal diseases 的研究论文。

论文截图
这项研究开发了一种用于治疗玻璃体视网膜疾病的「假细胞」技术。
玻璃体视网膜疾病中包含多种可能对视力造成威胁的疾病。其中,视网膜缺血再灌注损伤(RIRI)是许多玻璃体视网膜疾病中常见的病理过程。目前,缺血性视网膜病及其并发症的治疗包括激光光凝、眼内药物注射和玻璃体视网膜手术,这些治疗往往具有局限性并伴有风险。
而在细胞疗法方面,尽管取得了一些积极的成果,但其在眼科的应用仍存在一系列问题。如病理微环境对治疗细胞的功能表现出严重的负面影响;低氧张力、高氧化应激和营养剥夺可导致玻璃体内注射后治疗性细胞的存活率低,从而导致治疗效果受限;还有研究报告了干细胞转化为不需要的细胞(如肌成纤维细胞)的风险,这可能导致不良的治疗效果和不良的副作用。
此前已有研究证实,许多细胞治疗的获益涉及旁分泌机制。被称为外泌体的小分泌囊泡在多泡体(MVB)中产生,含有胞质蛋白、脂质和遗传因子,在细胞间通讯和细胞相互作用中发挥独立作用。此外,外泌体在冻干/再水化循环(Lyo/Reh)后保持治疗活性,并且不受病理微环境的影响。考虑到这些特性,外泌体可用于保留治疗性细胞的益处,同时克服与整个活细胞一起工作的局限性。
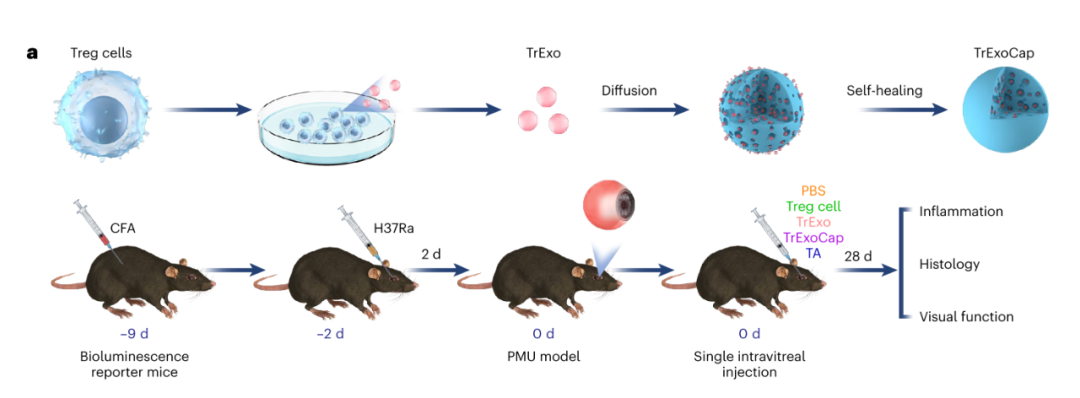
因此,研究人员设想使用一种类似「假细胞」的装置,将外泌体装载和密封到多腔微胶囊中,连续释放治疗性外泌体,以模拟小囊泡运输到天然细胞的 MVB 中。
在这项研究中,研究人员尝试验证「假细胞」在患有玻璃体视网膜疾病的小鼠和非人灵长类动物模型中的治疗效用。

论文截图
首先,研究人员从细胞上清液中分离外泌体,将外泌体(Exo)装载到聚乳酸-共-乙醇酸(PLGA)微胶囊(Cap)的稳定多腔内部,并诱导了一个温和的自我修复过程,在此过程中,表面孔隙愈合,产生了被称为「ExoCap」的假细胞。
在确认其冻干储存的能力后,研究人员观察到 ExoCap 在玻璃体内注射后沉降在玻璃体腔的下部区域,并且随着微胶囊降解,治疗性外泌体连续释放。
最后,使用 RIRI 和分枝杆菌葡萄膜炎(PMU)模型,研究人员检测了两种不同的 ExoCap 制剂的效果。
在视网膜缺血-再灌注损伤的小鼠模型中,进行玻璃体内注射时,包封小鼠间充质干细胞衍生的外泌体的微胶囊在下玻璃体腔中沉降,它们降解释放外泌体的时间超过一个月,并使视网膜恢复到接近健康的厚度。
在诱导的分枝杆菌葡萄膜炎小鼠模型和非人灵长类动物模型中,玻璃体内注射载有来自猴调节性 T 细胞的外泌体的微胶囊,使得炎症细胞水平大幅降低。
研究人员认为,这种可以冻干储存的外泌体封装微胶囊,可以为玻璃体视网膜疾病提供替代治疗选择。
未经允许不得转载:993113-生活与科技 » IF=29.234,陶勇团队最新研究发表

 993113-生活与科技
993113-生活与科技