【免费声明:以下文章内容信息均搜集自互联网或用户发布,并不代表本站观点或立场,本站不对其真实合法性负责。如有信息侵犯了您的权益,联系本站将立即删除。点击投诉删除】
本文作者:sysoon
可以「治愈」白血病等恶性血液系统肿瘤的抗癌药 CAR-T 治疗产品,最近却被质疑有引发 T 细胞淋巴瘤(T-cell Malignancy)的风险?
前天,FDA 发布公告:部分 CAR-T 治疗产品可能诱发 T 细胞淋巴瘤的「严重风险」,正在对当前已上市的 6 款 CAR-T 治疗产品进行调查[1]。其中,有 3 款已经在国内获批上市。

图源:FDA
FDA:或诱发 T 淋巴细胞瘤,风险不容忽视
自从 2017 年诺华的 CAR-T 治疗产品获 FDA 批准后,这款可以「治愈」白血病的药物就迅速取得全球关注。
CAR-T 疗法是指通过基因修饰技术,将带有特异性抗原识别结构域及 T 细胞激活信号的遗传物质转入 T 细胞,使 T 细胞直接与肿瘤细胞表面的抗原特异性相结合而被激活,通过释放穿孔素、颗粒酶素 B 等直接杀伤肿瘤细胞,同时还通过释放细胞因子募集人体内源性免疫细胞杀伤肿瘤细胞,从而达到治疗肿瘤的目的,而且还可形成免疫记忆 T 细胞,从而获得特异性的抗肿瘤长效机制。

CAR-T 细胞的制造过程,图源:参考资料[2]
在淋巴造血系统恶性肿瘤中,使用 CAR-T 治疗产品的适应症正在迅速扩大,目前已被用于治疗复发和/或难治性弥漫性大 B 细胞淋巴瘤、滤泡淋巴瘤、套细胞淋巴瘤、急性 B 细胞淋巴细胞白血病和多发性骨髓瘤等疾病。[3]
迄今为止,已有多款靶向 BCMA 以及 CD19 的 CAR-T 治疗产品获得 FDA 批准上市。此次 FDA 宣布调查的靶向 BCMA 的 CAR-T 治疗产品主要用于多发性骨髓瘤治疗领域,靶向 CD19 的 CAR-T 疗法则主要用于治疗复发/难治性 CD19+ B 细胞恶性肿瘤,相关疗效显著。[4]
但 FDA 收到临床试验和/或上市后的不良事件(AE)数据源后,表示需要对这两类疗法均可能诱发 T 细胞淋巴瘤的严重风险(包括住院和死亡)进行谨慎评估。[5]
目前,FDA 正在针对这两类细胞治疗产品中的 6 款已上市产品展开调查。其中,Yescarta、Tecartus 以及 Carvykti 此前已被国家药品监督管理局(NMPA)批准在国内上市。

本次调查的 6 款 CAR-T 细胞疗法产品,图源:FDA
FDA 认为,尽管上述产品的患者总体受益超过了潜在风险, 但仍需考虑进一步监管的必要性。
面对 FDA 发布的公告和调查,相关研发药企纷纷回应。Kite、诺华、BMS 的相关人员认为 FDA 公布调查的本司产品,目前尚不能确定与新的恶性肿瘤有关;杨森的相关发言人则表示已经和 FDA 共享相关数据,并将合作评估类效应安全信号。[5]
建议患者和受试者终身监测是否患新的肿瘤
在临床研究数据中,CAR-T 治疗产品在各种人体系统发生的严重不良反应主要包括免疫系统毒性(如细胞因子释放综合征,CRS)、神经系统毒性(如脑病、语言障碍等)、呼吸系统相关器质性病变(如缺氧、呼吸衰竭等)、心血管系统毒性等。[4]
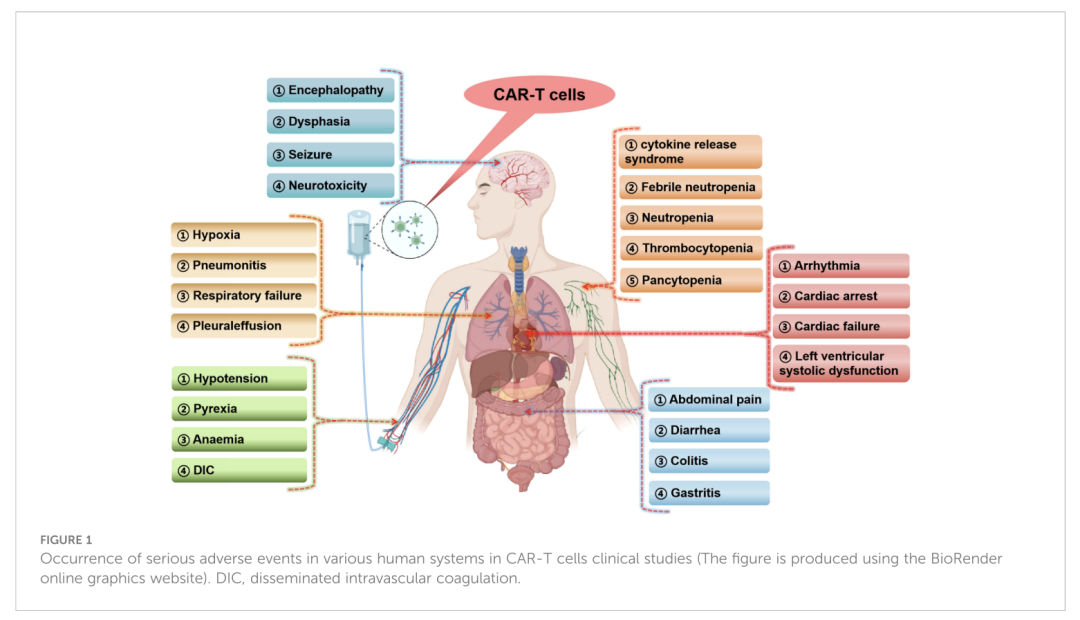
在 CAR-T 疗法的临床研究中,在人体各个系统中可能发生的严重不良事件。图源:[4]
此次 FDA 宣布调查的产品中,Kymriah 以及 Yescarta 同为靶向 CD19 的 CAR-T 细胞治疗产品。2021 年,一项发表在《欧洲临床药理学杂志》的研究统计并分析了 Yescarta 以及 Kymriah 在欧洲可疑药物不良反应报告数据库(Eudra Vigilance)(2018 年 9 月~2019 年 10 月 22 日)以及美国食品和药物管理局不良反应报告系统(FAERS)(2017 年 9 月~2019 年 6 月 30 日)中的不良反应事件。[6]
在该研究中,Eudra Vigilance 数据显示,Yescarta 共报告了 2650 起不良反应,其中报告最多的前 5 位依次为 CRS(498 例,18.8%)、神经毒性(247 例,9.3%)、发热(187 例,7.1%)、脑病(94 例,3.6%)以及低血压(75 例,2.8%)。Yescarta 在 FAERS 中报告的不良反应则为 2268 例,报告最多的前 5 位不良反应与 Eudra Vigilance 统计结果一致。
在 Eudra Vigilance 以及 FAERS 的统计中,另一种靶向 CD19 的 CAR-T 细胞疗法 Kymriah 均报告了超过 1500 例不良反应,其中报告最多的前 5 位为 CRS、发热、低血压、神经毒性以及恶性肿瘤进展。
对于靶向 BCMA的 CAR-T 治疗产品的不良事件,北京大学研究团队于今年 6 月发布了一项研究,基于 PubMed、Web of Science、EMBASE、Cochrane Library 等 6 个数据库检索了 21 项复发/难治性多发性骨髓瘤的治疗试验(共 751 名患者),并进行了 meta 分析评估。[7]

图源:参考文献[6]
研究结果显示,CRS 的总发生率为 82%(95%CI:72~91%),神经毒性的总发生率为 10% (95%CI:5%~17%)。
在这 21 项治疗试验中,靶向 BCMA 的 CAR-T 治疗产品相关的 ≥3 级不良事件(SAE)最常见的是血液毒性,包括中性粒细胞减少(86%,95%CI:76%~94%)、贫血(66%,95%CI:50%~81%)、血小板减少(62%,95%CI:49%~75%)等。
因此,尽管 CAR-T 细胞治疗产品已经在恶性血液系统肿瘤中不断取得突破,但是其不良反应同样不容忽视。正如 FDA 评估的那样,尽管上述产品的总体患者受益超过了潜在风险,但仍需考虑进一步监管的必要性。
目前,FDA 暂未公布调查结果,但建议「接受这 6 款产品治疗的患者和临床试验参与者,应终身监测是否患有新的血液肿瘤,一旦发现,需立即报告」。[1]
致谢:本文经 免疫与炎症全国重点实验室副教授 虞淦军、 浙江省肿瘤医院淋巴瘤科主治医师 李聪、沈阳市红十字会医院血液科主任医师 金涛、首都医科大学同仁医院血液科副主任医师 丛佳 专业审核
【专家解读】
免疫与炎症全国重点实验室副教授 虞淦军 审核意见:
自 2012 年 Emily Whitehead 接受 CAR-T 细胞治疗取得成功,到多款 CAR-T 细胞治疗产品上市,再到目前「家喻户晓」的「天价细胞针」,短短的十多年时间里,CAR-T 细胞治疗的发展可谓飞速。在追求获益的同时,我们同样需要承担一些风险,尤其是一些长期风险。这些长期风险在前期短期的观察中可能尚未充分暴露,仍需进一步的追踪和随访,甚至终身随访。
对于 CAR-T 细胞治疗产品中的插入突变或致癌/成癌风险,科学家们早已有所警惕,并且探索了一些应对策略。如在制备 CAR-T 细胞的工艺中,导入「自杀基因」或「安全开关」,从而对体内的 CAR-T 细胞实现「人工调控」;或者开发一些非病毒载体的基因递送系统,降低插入风险等。随着对 CAR-T 细胞的不断深入研究,我们相信,在不久的将来一定将出现更安全、更有效的产品。
另外,根据国内外药物研发和上市的一般规则,药品被批准上市并不是意味着「万事大吉」、「高枕无忧」了。上市后的药品同样需要面临上市后监管,接受真实世界中更大样本量的安全性和有效性「考验」。
对于新发现的或可疑且非预期的严重不良反应,需要监管部门及时介入调查,并采取有关的监管措施。例如此前因安全性问题而撤市的药物有罗非昔布(心血管毒性)、加替沙星(代谢紊乱)、曲格列酮(肝毒性)等等;2021 年也曾经出现了一系列 PD-(L)1 类上市药物因为验证性临床试验中有效性数据不佳而撤出部分适应症的事件。
浙江省肿瘤医院淋巴瘤科主治医师 李聪 审核意见:
CAR-T 疗法是近年来全球最热门的细胞免疫治疗技术之一,将人的 T 细胞经过基因工程手段体外修饰改造后,以生成嵌合抗原受体(CAR)的特殊受体。这些 CAR 使 T 细胞能够识别癌细胞表面的抗原,并激活T细胞杀死这些癌细胞的能力。因为独特的作用机制,CAR-T 疗法可能克服肿瘤细胞对细胞毒药物的耐药,已有多项大型临床试验结果表明 CAR-T 疗法彻底改变了多种淋巴造血系统肿瘤的预后。
最受人关注的毒性为细胞因子释放综合征和神经毒性,但随着研究的深入和临床应用的不断增多,CAR-T 治疗产生的其他不良反应正逐渐被关注。2023 年4 月,Nature 发表的一篇综述报告了美国国家癌症研究所从接受 CAR-T 细胞治疗的B细胞恶性肿瘤患者中获得的十几年的随访数据,迄今为止观察到的最常见的长期不良反应是 B 细胞耗竭、低丙种球蛋白血症,血细胞减少和感染[3]。另外,各项研究报道的第二肿瘤发生率约为 4%~16%。
但目前还缺乏足够证据表明经批准的 γ 逆转录病毒或慢病毒 CAR 递送系统会增加继发性恶性肿瘤的风险。针对 FDA 展开调查的 CAR-T 产品,我们也将持续关注调查结果,密切随访患者状态,并保持审慎态度。
沈阳市红十字会医院血液科主任医师 金涛 审核意见:
CAR-T 疗效远大于风险是公认的,其不良反应也很显著,我们临床选择需要的是可靠的风险收益评估,对风险的评估不能因为其收益巨大而弱化,此次FDA 调查估计是程序性引发的,对我们可靠开展临床评估是有帮助的。风险评估应该是不夸大不缩小、客观的。本文及时推出有助于国内相关医疗工作者跟随医疗前沿动向,也能让相关患者正确对待 CAR-T、免受蒙蔽。
首都医科大学同仁医院血液科副主任医师 丛佳 审核意见:
CAR-T 疗法是一种针对特定抗原的免疫疗法,用于治疗血液系统恶性肿瘤,取得传统化疗放疗难以企及的疗效,是一个具有划时代意义的疗法,目前除了血液系统肿瘤外,针对实体瘤的 CAR-T 疗法的临床试验也在如火如荼地进行中,甚至可能会拓展到非肿瘤性疾病。其副作用当然不容忽视,上文提到的 CRS、ICANS、B 细胞耗竭、CAR-T 细胞异常扩增、继发第二肿瘤等等,其发生率、危险因素、处理流程已经被大家关注并写进各大指南共识,在临床上的使用中总体较为可控。
目前,尚不清楚 FDA 关于 CAR-T 疗法存在诱发 T 细胞淋巴瘤的警告背后的原因,我们当然要持续关注这些新技术可能带来的副作用,持续监测可能未知的严重副作用,采取措施避免或者减轻副作用,但我们也不能因噎废食,畏惧或者放弃这种很多情况下甚至是唯一能治愈肿瘤的方法。
策划:sysoon|监制:carollero
未经允许不得转载:CYQY-生活与科技 » 最新!FDA 宣布调查 CAR-T 疗法:可能导致 T 淋巴细胞瘤

 CYQY-生活与科技
CYQY-生活与科技