【免费声明:以下文章内容信息均搜集自互联网或用户发布,并不代表本站观点或立场,本站不对其真实合法性负责。如有信息侵犯了您的权益,联系本站将立即删除。点击投诉删除】
8 月 26 日,据国家药品监督管理局药品评审中心查询信息,司美格鲁肽注射液新增 2 条注册受理,注册分类为 2.2。
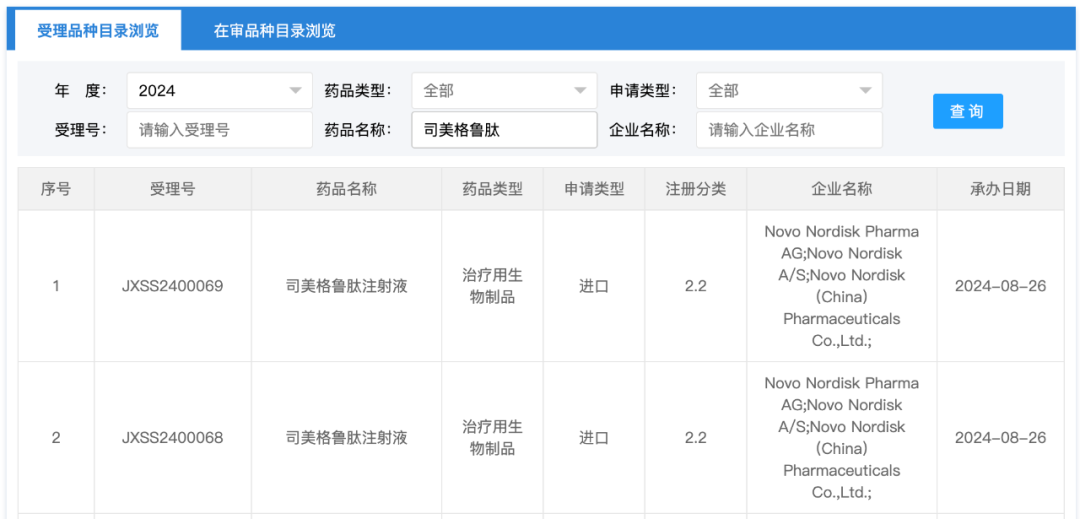
国家药品监督管理局药品评审中心截图
根据国家药监局公布《生物制品注册分类及申报资料要求》,治疗用生物制品注册分类 2.2 为「增加境内外均未获批的新适应症和/或改变用药人群」。
据推测,新适应症很有可能为 2 型糖尿病合并慢性肾病。
此前 5 月 24 日,在欧洲肾脏学会 2024 年会上,FLOW 试验结果,显示司美格鲁肽降低了患有 2 型糖尿病和慢性肾病的患者发生主要肾脏事件、心血管死亡的风险。
FLOW 是一项随机、双盲、平行组、安慰剂对照试验,以糖尿病治疗剂型的司美格鲁肽注射液 1.0mg 与安慰剂对照试验于 2019 年启动,在 28 个国家进行,共入组 3534 例患者。此前已因疗效突出而提前终止临床试验。
结果显示,与安慰剂相比,接受 1.0 mg 司美格鲁肽治疗的患者肾脏疾病进展以及心血管和肾脏死亡率显著降低 24%。司美格鲁肽组发生主要心血管事件的风险比安慰剂组低 18%、全因死亡风险比安慰剂组低 20%。
诺和诺德官网表示,或于 2024 年内在美国和欧盟递交司美格鲁肽适应症扩展申请。
未经允许不得转载:CYQY-生活与科技 » 刚刚!司美格鲁肽新适应症国内申报上市

 CYQY-生活与科技
CYQY-生活与科技









