刚刚,康方生物宣布,该公司独立研发的 PD-1/CTLA-4 双特异性抗体——卡度尼利单抗注射液,今天获批新适应症:联合含氟尿嘧啶类和铂类药物化疗,用于局部晚期不可切除或转移性胃或胃食管结合部腺癌患者的一线治疗。
这是继 2022 年 6 月获批上市后,卡度尼利单抗在中国获批的第二项适应症。

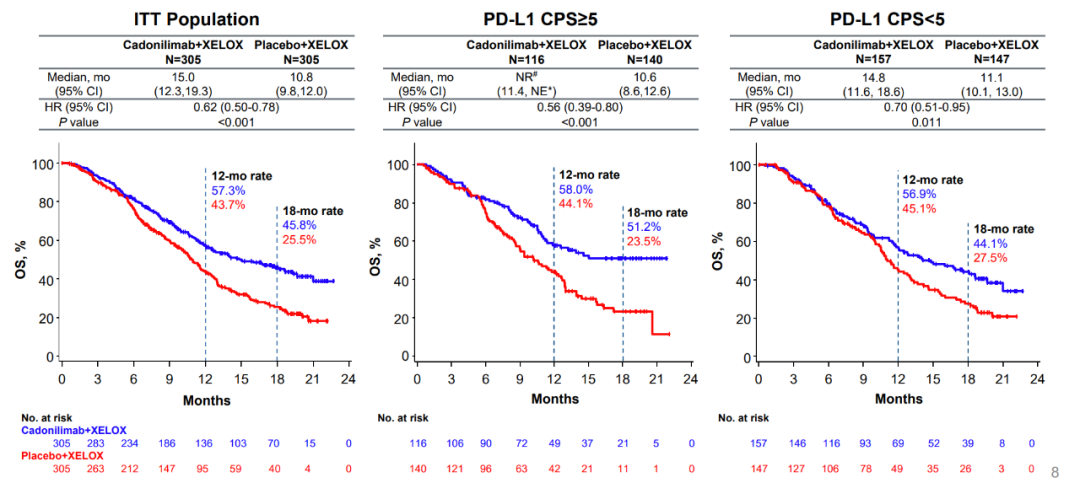
本次新适应症获批基于一项随机、双盲、多中心的 III 期临床试验(COMPASSION-15/AK104-302)。研究结果显示,相比于对照组(单纯化疗),实验组(卡度尼利单抗联合化疗)可延长患者总生存期达 4.2 个月(15.0 vs 10.8 个月),且死亡风险降低 38%(HR=0.62)。
此外,该研究还发现,卡度尼利单抗联合化疗不仅使 PD-L1 高表达(CPS≥5)患者的死亡风险降低了 44%,也将 PD-L1 低表达(CPS<5)患者的死亡风险降低了 30%。
而此前在 9 月 27 日刚刚结束的 FDA 肿瘤药物咨询委员会(ODAC)会议上,由于「对于 PD-L1 表达小于 1 的患者,PD-1 抑制剂的治疗效果似乎微不足道或不太有利」,FDA 正在考虑是否缩小已获批的几款 PD-1 抑制剂的适应症范围。(点击查看丁香园往期文章:刚刚!PD-1 直面 FDA 大考,压倒性投票,考虑限制适应症)
COMPASSION-15/AK104-302 临床试验的一位主要研究者表示:「卡度尼利单抗联合化疗新适应症的获批,填补了目前 PD-1/L1 单抗在 PD-L1 低表达及阴性人群中疗效不足的空白。」
除了一线胃癌获批外,卡度尼利单抗联合 VEGFR-2 单抗用于治疗经 PD-1/L1 抑制剂联合化疗治疗进展的晚期胃癌的注册性 III 期临床研究也已经启动。
策划:肯德羊 | 监制:carollero、z_popeye
未经允许不得转载:CYQY-生活与科技 » 刚刚!这个药获批胃癌一线治疗

 CYQY-生活与科技
CYQY-生活与科技