本文作者:usagi
当地时间 7 月 2 日,礼来公司生产的 Kisunla™(donanemab-azbt)获 FDA 批准用于治疗早期症状性阿尔茨海默病。

图源:礼来
全球第二款 AD 新药,来了。
每月一针,治疗 18 个月后,淀粉样斑块平均减少 84%
阿尔茨海默病(Alzheimer’sdisease,AD)是以进行性认知功能障碍和精神行为损害为特征的中枢神经系统退行性疾病。临床上表现为记忆下降、失语、失用、失认、视空间能力损害、抽象思维和计算力损害、人格和行为改变等。
AD 具体病因尚未完全阐明,但其病理特征明确,即 AD 患者的大脑出现 β 淀粉样蛋白斑块沉积、tau 蛋白异常磷酸化和神经纤维缠结形成,最终导致神经元及其突触丧失。
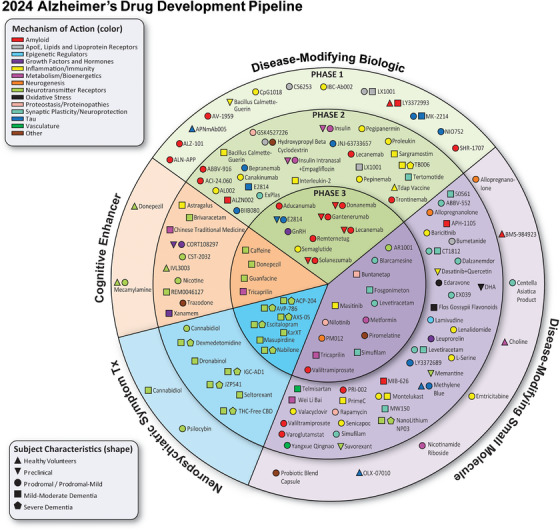
截至 2024 年 1 月 1 日在 clinicaltrials.gov 上记录的 AD 治疗临床试验药物;图源:参考文献 11
donanemab 是一种抗淀粉样蛋白单克隆抗体(anti‐amyloid monoclonal antibodies, AA‐MABS),可与 β 淀粉样蛋白亚型 N3pG 结合,从而促进患者大脑中淀粉样蛋白斑块的清除。
FDA 本次批准 donanemab 用于轻度认知障碍(MCI)患者以及轻度痴呆阶段的 AD 患者,并已确诊为淀粉样蛋白病理。同时,donanemab 也是第一款且唯一一款针对淀粉样斑块的治疗方法。
2023 年 7 月 17 日,礼来公司公布了 III 期研究 TRAILBLAZER-ALZ 2 的完整结果,显示 donanemab 显著减缓了早期症状性 AD 患者的认知和功能衰退。这些数据在 2023 年阿尔茨海默病协会国际会议(AAIC)上作为专题研讨会分享,并同时发表在 JAMA 杂志上:

clinicaltrials.gov 截图
该临床试验在淀粉样蛋白(amyloid)阳性的基础上,根据脑内 tau 蛋白水平,将参与者分为低-中 tau 组(有时称为中等 tau)或高 tau 组,后者代表疾病进展的晚期病理阶段。所有参与者在 18 个月内使用包括 AD 综合评分量表(iADRS)和临床痴呆评定量表(CDR-SB)在内的多个量表进行认知和功能评估。
参与者以 1:1 的比例随机分配接受 donanemab(n = 860)或安慰剂(n = 876),每 4 周接受一次 30 分钟静脉输注,共 72 周。如果满足剂量完成标准,即淀粉样蛋白清除率达标,donanemab 组的参与者将以盲法转为接受安慰剂。
在低-中 tau 蛋白水平的参与者中(n=1182),donanemab 治疗组在 iADRS 得分上显著减缓了 35% 的衰退,在 CDR-SB 上减缓了 36% 的衰退。在所有淀粉样蛋白阳性的早期症状性阿尔茨海默病研究参与者中(n=1736),donanemab 治疗在 iADRS 上显著减缓了 22% 的衰退,在CDR-SB 上减缓了 29% 的衰退。
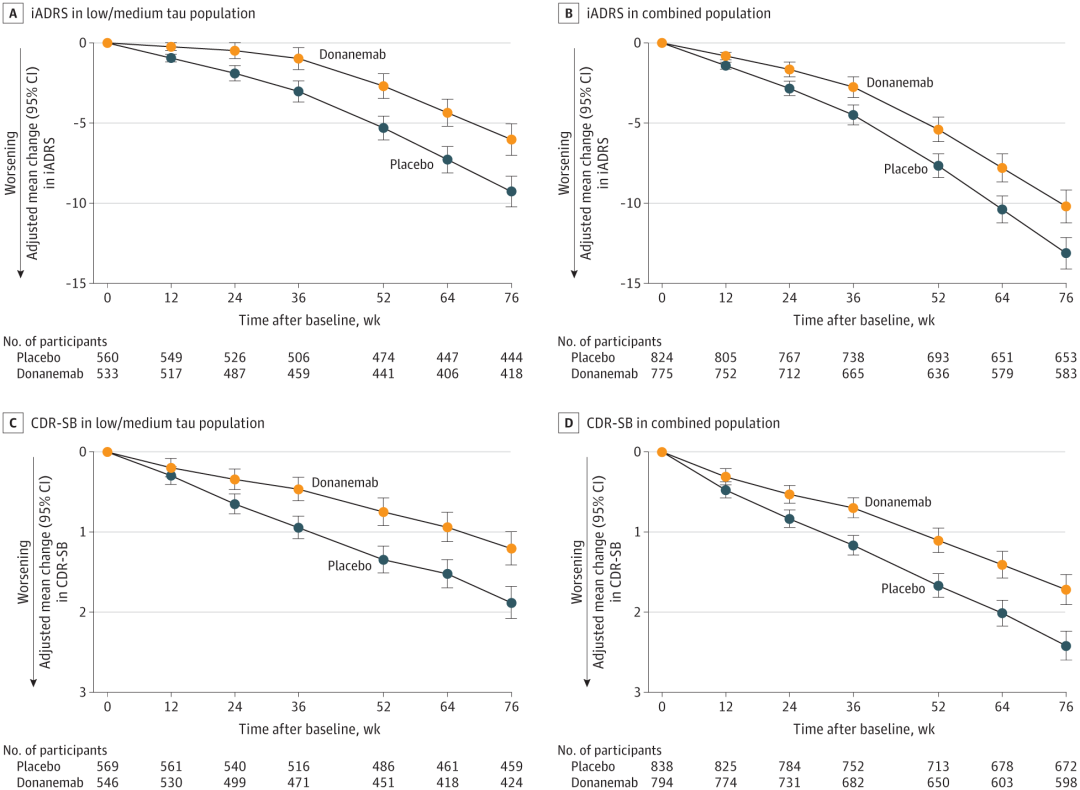
A, 35.1% slowing of clinical progression. B, 22.3% slowing of clinical progression. C, 36.0% slowing of clinical progression. D, 28.9% slowing of clinical progression;图源:参考资料 1
donanemab 专门针对沉积的淀粉样斑块,并已被证明可清除接受治疗的患者脑内的淀粉样斑块。无论疾病的基线病理阶段如何,使用 donanemab 治疗均可显著降低淀粉样斑块水平。在所有参与者中,使用 donanemab 治疗 18 个月后,淀粉样斑块平均减少了 84%,而使用安慰剂的参与者减少了 1%。
参与者在临床试验固定阶段检查达到淀粉样斑块清除的预定标准,便可以停止服用 donanemab。大约一半的参与者在 12 个月时达到了这一阈值,大约每十名参与者中就有七名在 18 个月时达到了这一阈值。
对于处于疾病早期病理阶段的低中 tau 水平的受试者,使用 donanemab 治疗后,47% 的受试者在一年后的 CDR-SB 评估中没有进展,而使用安慰剂治疗的受试者 29% 在一年后的 CDR-SB 评估中没有进展。在为期 18 个月的试验中,使用 donanemab 治疗的受试者进入下一临床阶段疾病的风险也降低了 39%。
这种进展延迟意味着,与使用安慰剂的受试者相比,使用 donanemab 治疗的受试者平均需要额外 7.5 个月才能达到 CDR-SB 评估中相同的认知和功能衰退水平。
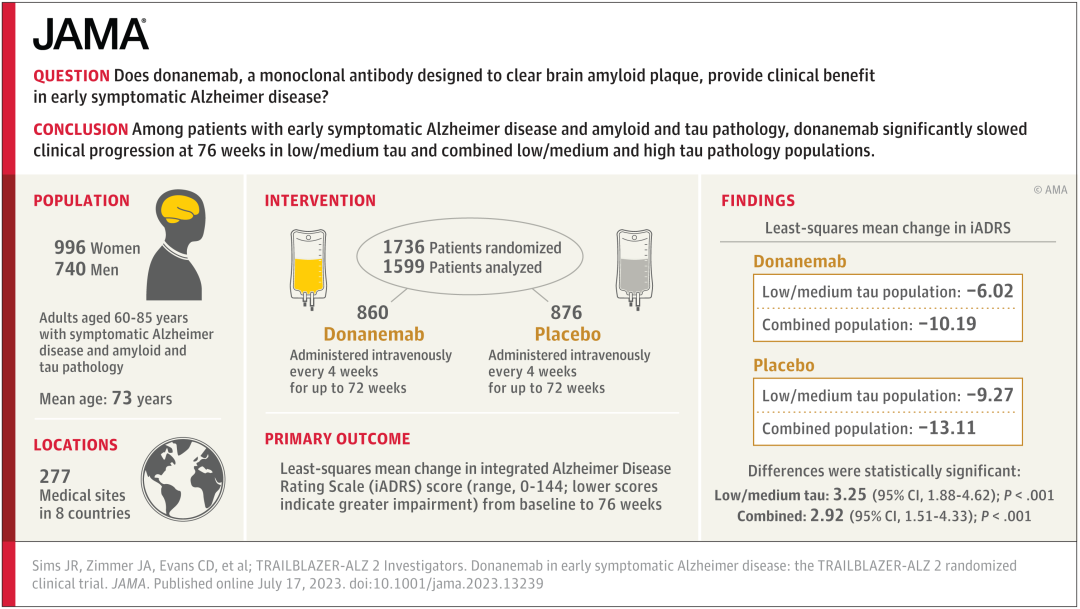
图源:参考资料 1
基于上述研究结果,在早些时候召开的 FDA 总部会议上,FDA 外周和中枢神经系统药物咨询委员会(下称:委员会)的全部成员以 11:0 的投票结果,认可礼来生产的 donanemab 对早期阿尔茨海默患者的收益大于风险。
峰回路转,全球第二款 AD 新药上市,一年 23 万
donanemab 的上市之路并非一帆风顺。
2021 年 1 月,礼来公司宣布顺利地完成 II 期临床试验 TRAILBLAZER-ALZ,该试验评估 donanemab 在早期症状性 AD 患者中的安全性、耐受性和有效性,试验结果发表在 NEJM。

clinicaltrials.gov 截图
该研究显示,在早期 AD 患者中,donanemab 在 76 周时比安慰剂在认知能力和日常生活活动能力的综合评分上表现更好,尽管次要结果的表现不一。需要更长时间和更大规模的试验来研究 donanemab 在阿尔茨海默症中的疗效和安全性。

2021 年 10 月,礼来公司宣布已基于上述研究结果启动了 donanemab 用于早期阿尔茨海默病加速批准的滚动程序。
然而 2023 年 1 月,FDA 称不会提前批准该药物,原因是提交中提供的至少 12 个月药物暴露数据的患者数量有限。FDA 特别要求礼来公司提供至少 100 名接受了至少 12 个月的持续 donanemab 治疗的患者的数据。
直至 2023 年 5 月,礼来顺利完成上述 III 期临床试验 TRAILBLAZER-ALZ 2,并再次递交上市申请。原计划 FDA 将在 2024 年第一季度对上市申请进行审议并作出决定。然而,由于需要深入讨论 donanemab 的若干核心问题,FDA 决定召开专门委员会会议,以全面审慎地评估相关情况。因此,原定的审批时间有所推迟。
根据业内人士透露,FDA 要求礼来公司收集提前终止临床试验受试者的存活状况 ,以更新安全性数据。
安全数据更新前,donanemab 组和安慰剂组的死亡率分别为 1.8% 和 1.2%。按照 FDA 的要求更新后,donanemab 组和安慰剂组的死亡率分别为 2.0% 和 1.7%
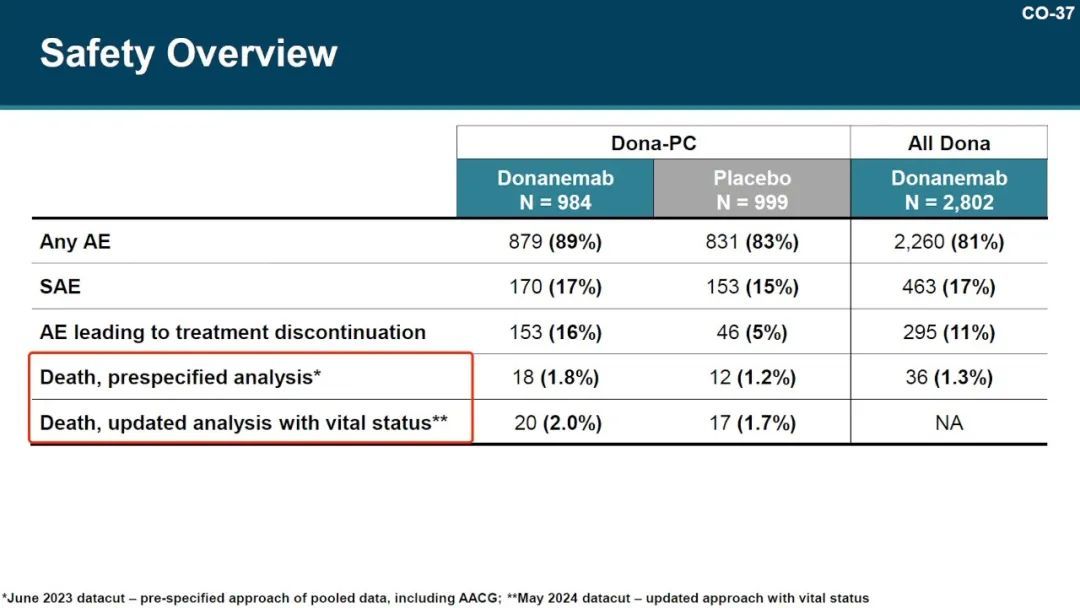
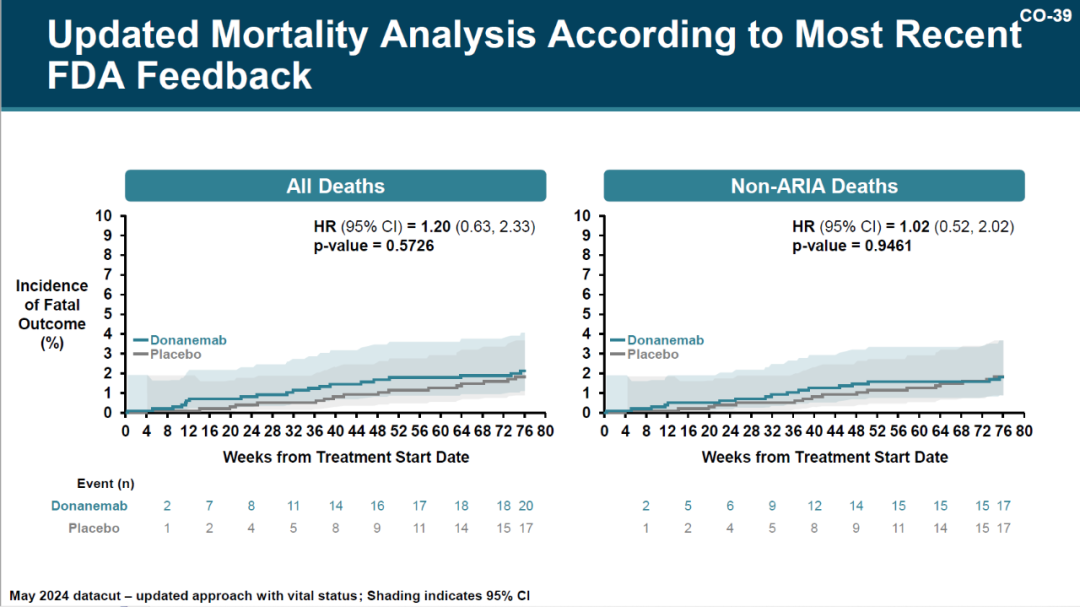
图源:参考资料 10
与其他降低淀粉样蛋白的药物以及 2 期 TRAILBLAZER-ALZ 试验类似,淀粉样蛋白相关影像异常 (ARIA)是一种相关不良事件,最常见的表现是大脑一个或多个区域的暂时性肿胀 (ARIA-E) 或微出血或浅表铁质沉积 (ARIA-H)。
使用 MRI 确定的 ARIA 发生率,在 donanemab 组比安慰剂组更高(donanemab 组 268 名参与者[31.4%],安慰剂组 119 名参与者[13.6%])。
对于 1.6% 的 donanemab 治疗组参与者, AIRA 导致了严重后果,例如住院治疗,并需要支持治疗和/或使用皮质类固醇。同样值得注意的是,TRAILBLAZER-ALZ 2 中有 3 例死亡发生在严重的 AIRA 之后。
当地时间 6 月 10 日,FDA 独立科学顾问委员进行审查,根据 II 期和 III 期临床试验的结果,委员会就两个具体问题进行了投票。
(左右滑动可查看)





(左右滑动可查看)
对于数据是否表明该药对治疗阿尔茨海默病有效,以及该药在临床试验人群中治疗阿尔茨海默病的益处是否大于风险的问题,委员会以 11:0 的票数一致投票「是」。
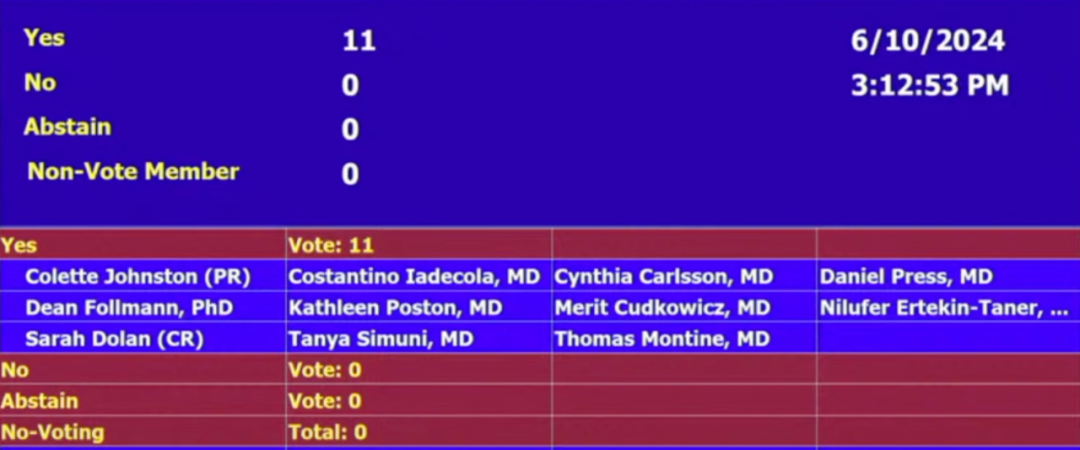
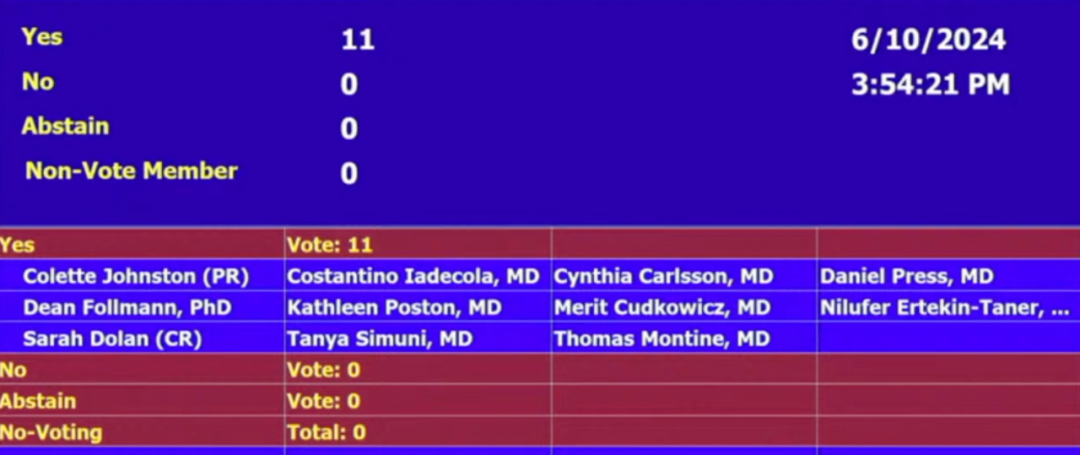
FDA 截图
同时,FDA 在处方信息中标注针对淀粉样蛋白相关成像异常(ARIA)的黑框警告,与杂合子和非携带者相比,ApoE ε4 纯合子患者的 ARIA 发病率更高,包括有症状的 ARIA 和严重的 ARIA。在开始治疗之前,应进行 ApoE ε4 状态检测,以了解罹患 ARIA 的风险。
目前,donanemab 的定价为 695.65 美元/瓶(约合人民币 5067 元/瓶)。不过,根据 III 期研究结果,17% 患者在 6 个月时完成治疗,47% 在 12 个月时完成治疗,69% 在 18 个月时完成治疗;所以实际需要的总费用将根据患者完成治疗的时间而有所不同。

使用 donanemab 6 个月、12 个月、18 个月 分别需要(约合人民币)9 万元、23 万元、35 万元;图源:礼来
除此之外,礼来仍在多项临床试验中继续对 donanemab 的研究,包括:
▶ TRAILBLAZER-ALZ 3:该试验旨在预防临床前 AD 参与者出现症状性 AD;
▶ TRAILBLAZER-ALZ 4,旨在比较 donanemab 与 aducanumab 对早期症状性 AD 患者脑淀粉样斑块清除率的影响;
▶ TRAILBLAZER-ALZ 5,旨在评估 donanemab 对早期 AD 患者的安全性和有效性,目前正在中国招募参与者;
▶ TRAILBLAZER-ALZ 6,该试验旨在通过新型 MRI 序列、血液生物标志物和不同的 donanemab 剂量方案来扩展对 ARIA 的理解。
致谢:本文经 复旦大学附属华山医院神经内科主任医师、博士生导师 郁金泰教授 专业审核
【注】
复旦大学附属华山医院神经内科主任医师、博士生导师 郁金泰教授 审核意见:
近年来,阿尔茨海默病(AD)疗法不断取得突破,尤其是在 Aβ 靶向的疾病修饰治疗领域。Donanemab 的有效性和安全性数据获得 FDA 委员会的一致认可,这标志着该药物有望顺利上市,为早期 AD 患者提供一种全新的治疗选择,并显著延缓他们的疾病进程。
Donanemab 每月仅使用一次,不仅丰富了现有 Aβ 靶向疗法的药物种类,还为患者及其家属提供了较高的便利性。这一进展不仅是 AD 治疗领域的重要里程碑,也显示了医学界在精准治疗和管理 AD 方面的持续进步。临床医生和患者应密切关注这一动态,以为早期 AD 患者争取最佳治疗窗口期。
策划:yuu.|监制:gyouza, carollero
未经允许不得转载:CYQY-生活与科技 » 重磅!一年 23 万,礼来这款新药刚刚获批上市
 CYQY-生活与科技
CYQY-生活与科技









